Баскетбол.
Бокс.

Хирн хочет подписать Кроуфорда
Фото: Getty Images Промоутер Эдди Хирн заявил, что он заинтересован в подписании топа рейтинга pound-for-pound Теренса Кроуфорда (38-0, 29 KO). Слова Хирна приводит boxingscene.com: Конечно, я бы хотел подписать Кроуфорда. …
Волейбол.
Гандбол.
Регби.
Теннис.

Глава WTA: Последнее интервью Пэн Шуай не уменьшает наших опасений
Глава WTA Стив Саймон прокомментировал слова китаянки Пэн Шуай, сказанные в интервью L'Equipe. Пэн Шуай: Никогда не писала о сексуальном насилии, я сама удалила тот пост, потому что мне так …
Футбол.
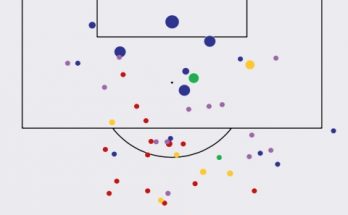
Месси наконец снова забил в Лиге 1. Собрали все удары на одну картинку – Лео дико не везет с реализацией
Лео Месси наконец-то забил за «ПСЖ» в Лиге 1 – вписался в гостевой разгром «Лилля» (5:1). Между первым и вторым голом аргентинца прошло 78 дней – результативность Месси во Франции …













































